分享到:
- 微信
- 微博


{{aisd}}
AI生成 免责声明
9月13日,国务院新闻办公室举行新闻发布会。在会上,国家药品监督管理局局长李利介绍,党的二十届三中全会通过的《决定》提出要完善推动生物医药等战略性产业发展政策和治理体系,健全强化医疗装备等重点产业链发展体制机制,健全支持创新药和医疗器械发展机制等。药品监管部门正在按照全会部署,谋划全面深化药品监管改革的一揽子政策措施,着力打造具有全球竞争力的医药创新生态,加快创新药品和医疗器械上市步伐,提高医药产业发展的质量和效益。
一是加大对医药研发创新的支持。对国家重点支持的创新药品和医疗器械,在审评审批、检验核查等方面加强服务指导,引导企业坚持以临床价值为导向,以患者为中心制定研发策略。加强产品注册申报的政策宣传和技术咨询,整合国家和省级药品监管部门技术力量,建立多渠道多层次的沟通方式,利用线上渠道办好药品、医疗器械审评审批云课堂。提升创新药品和医疗器械的可及性,落实党中央关于深化“三医”协同发展和治理的决策部署,积极支持创新药械进医院、进医保。
二是提高审评审批效率。加快临床急需产品的审评审批,将符合条件的产品纳入优先审评审批程序,缩短技术审评、注册核查、注册检验等各环节时限,加快审批步伐。缩短临床试验默示许可时限,在北京、上海等地开展试点,将创新药临床试验审评审批时限由60个工作日缩短至30个工作日。优化药品补充申请审评审批程序,在有条件的省份开展试点,提供药品上市后变更注册核查和注册检验前置服务,大幅压缩补充申请审评时限。
三是支持医药行业开放合作。加强国际通用监管规则在国内的转化实施,支持开展国际多中心临床试验,促进全球药物在中国同步研发、同步申报、同步审评、同步上市。探索生物制品分段生产模式,在部分地区开展创新和临床急需生物制品分段生产试点。加大对医药进出口贸易的支持力度,加快境外已上市新药在境内上市审批,鼓励跨国企业把原研化学药品、生物制品和高端医疗装备等转移到国内生产。完善药品出口销售证明相关政策,鼓励我国更多医药企业走出国门参与国际贸易,让中国药品造福全人类。
文章作者
中国研制纤维芯片成果再登顶刊!“头发丝里实现大规模集成电路”
中国团队在国际上率先研制出“纤维芯片”。要实现纤维器件的更大规模化应用,必须攻克“芯片”的核心技术壁垒,包括空间限制、光刻适配以及稳定性挑战。

国家医保局首次明确机器人手术收费指引
机器人手术已经成为医疗精准化的代表。近年来,手术机器人企业创新能力不断增强,产品上市获批速度越来越快,医疗机器人在参与手术的过程中如何收费是业内高度关注的。
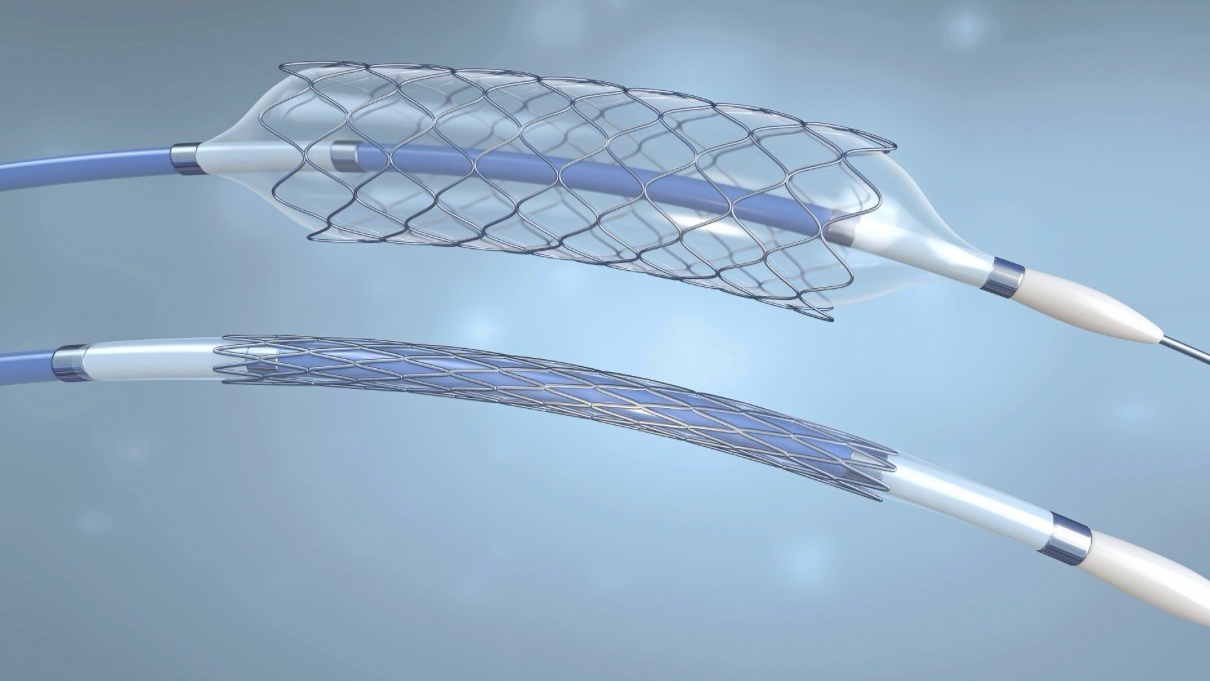
新一轮集采后冠脉“硬通货”大降价!近万元药物球囊普降至两千多元
自冠脉支架集采落地后,药物涂层球囊用量上涨显著,是公立医院心血管病科最重要的手术高值耗材之一。

这一医疗器械在美国高度垄断,“瓣膜之王”收购遇阻!中国市场百花齐放
心脏瓣膜因研发壁垒高,一直被视为医疗器械皇冠上的明珠。在全球市场上,头部企业主导市场的趋势日益显著。

李西廷2亿增持迈瑞医疗,名下持股平台曾套现超百亿
半个月已经买完,增持不到总股本千分之一。
