分享到:
- 微信
- 微博
AI帮你提炼, 10秒看完要点
智能挖掘相关板块, 定位投资机会


AI速读
节省3分钟阅读时间 {{aisd}}
AI生成 免责声明
“仿制药一致性评价大量数据雷同”,传输错误,目前已更新。
1月24日,一篇网络文章 “仿制药一致性评价大量数据雷同”引发热议,仿制药一致性评价的数据一旦造假,中国的药品是否还值得信赖?是否还能吃?
网文作者针对瑞舒伐他汀钙片的两家生产企业南京正大天晴与 Lek Pharmaceuticals d.d的通过仿制药一致性评价的生物等效性试验数据进行了对比,其参比制剂为阿斯利康生产,商品名「可定」。在对比时发现:两家企业的生物等效性试验数据一模一样。
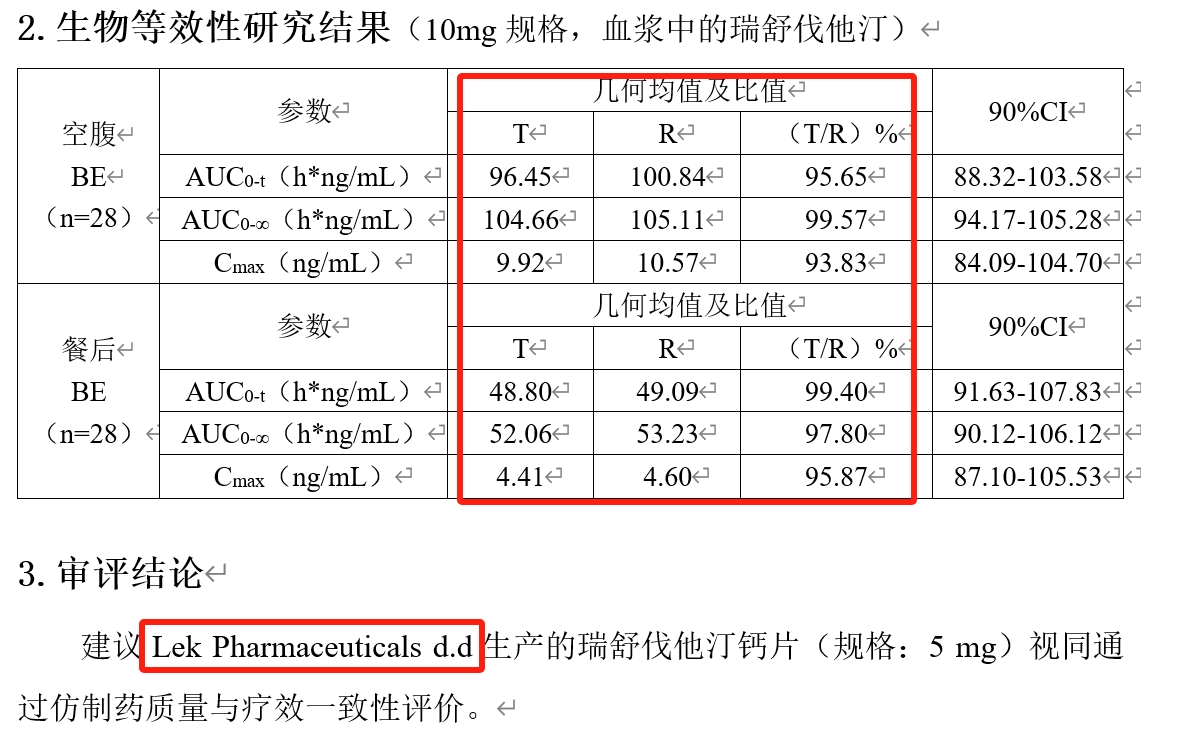
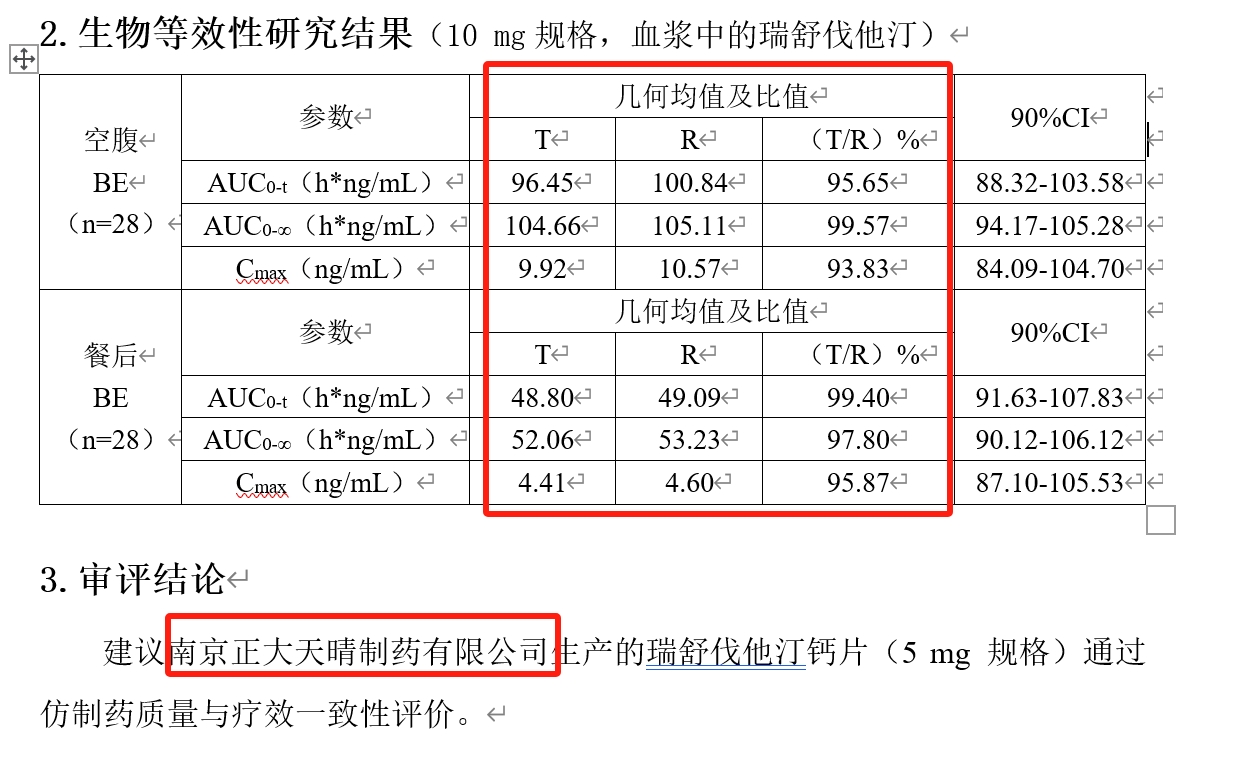
第一财经从国家药品监督管理局药品审评中心找到了正大天晴与Lek Pharmaceuticals d.d的文件,数据的确一致,而且丝毫不差。如此一致的数据,是抄袭造假?还是传输错误?
“任何一个生物等效性试验,都不可能出现一模一样的数据,BE一个统计学数据,只能说相差不大,没有统计学差异,是可能存在的,数据一模一样是不可能的,这不是指含量的大小,这样的数据在医学科学上不存在。如果看作抄袭造假,可能也不大,首先这两家企业都是比较强的企业,其次,抄袭和造假数据,也不会如此抄袭造假,太醒目了。所以,出现这种数据的可能性较大的原因是平台上传时输入错误。”一位参与仿制药一致性评价的专家表示。
一位消息人士透露,“目前已经从平台后台查询到,两家企业的数据不一样,是当时导入上传时出现的错误。”
事实上,截止到记者发稿,国家药品监督管理局药品审评中心的数据已经发生了变化,Lek Pharmaceuticals d.d的BE数据被更新。
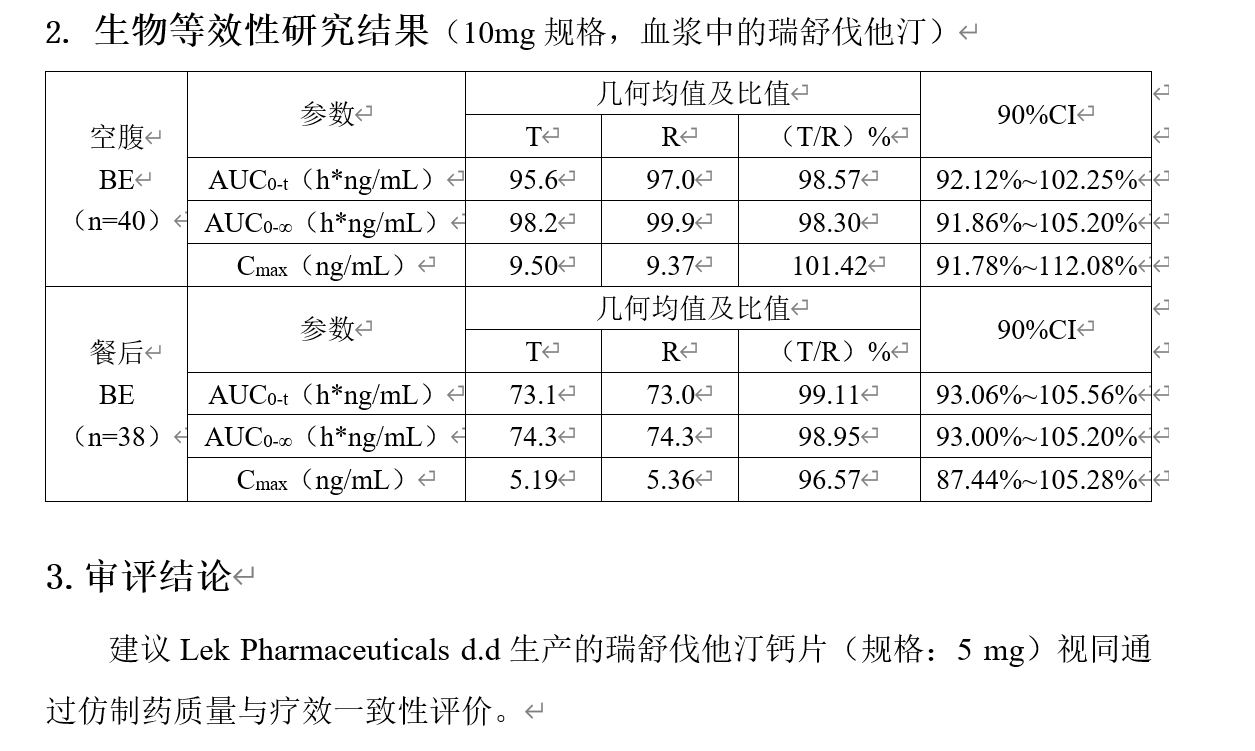
由此,针对严谨科学的数据,仍需给予谨慎关注,否则导致中国药品再次陷入不信任危机。
举报
第一财经广告合作,请点击这里
此内容为第一财经原创,著作权归第一财经所有。未经第一财经书面授权,不得以任何方式加以使用,包括转载、摘编、复制或建立镜像。第一财经保留追究侵权者法律责任的权利。如需获得授权请联系第一财经版权部:banquan@yicai.com
文章作者
一财最热





