分享到:
- 微信
- 微博


{{aisd}}
AI生成 免责声明

谈到苏州工业园区,不得不提到由它孵化的苏州生物医药产业园(BioBAY)。政府公开信息显示,2006年,生物医药及大健康产业就被苏州工业园区视作重点规划、引导和培育的战略新兴产业之一。随后,园区大力发展生物医药及大健康产业。今年,苏州工业园区市场监管局更是获得了江苏省药监局药品生产/经营许可证换发事项的正式赋权。
将“BioBAY”这个词汇进行简单的拆解,它可以翻译为“生物港湾”。事实上,作为苏州工业园区发展生物医药产业的高科技载体,这个于2007年正式启用的园区,也确实在17年间培育了众多生物医药高科技创新企业,为它们提供了成长的港湾。最新数据显示,BioBAY中的生物医药高科技创新企业数量已经达到620多家。信达生物制药(苏州)有限公司(下称“信达生物”)就是其中之一。
国内市面上销售的信迪利单抗注射液(达伯舒®)、贝伐珠单抗注射液(达攸同®)、阿达木单抗注射液(苏立信®)等药物,都是信达生物的产品。目前,公司有18个产品已经获得批准上市,在中国生物医药领域具备了一定的竞争力。
BioBAY与信达生物之间的故事或许可以用“双向奔赴”来形容。2011年,曾在国内外多家制药公司任职重要岗位的俞德超博士来到苏州工业园区,创立了信达生物。在创业的早期,苏州不仅给予土地支持,政府还出资代建研发生产基地,为企业后续的发展提供了有力支持,而信达生物后来的快速成长也确实不负期许。
信达生物自成立以来,致力于实现“开发出老百姓用得起的高质量生物药”的企业使命和目标。目前,企业的目标产品主要有两个特点——“生物药”和“创新药”。“生物药”指的是生物大分子药物,主要应用普通的或以基因工程等生物技术获得的微生物、细胞等生物材料制备的用于人类疾病预防、治疗和诊断的药品。与化学小分子药物相比,生物药靶向性高,但开发和生产的难度也更高。“创新药”是具有自主知识产权专利的药物,这是一个与“化学仿制药”“生物类似药”等仿制类别产品相对的概念。
通常来说,研发投入高、产品回报周期长是生物创新药产业的主要特征,这些企业往往只有在国内站稳脚跟、产品在全球市场具有极大竞争力时,企业才会考虑全球化发展。当前的信达生物收入主要为医药产品销售收入和授权费收入。其中,医药产品销售主要面向国内,2024年该项收入同比增长43.64%至82.28亿元。近年来,信达生物的产品在国内具有一定的市场规模,企业也开始规划产品出海。
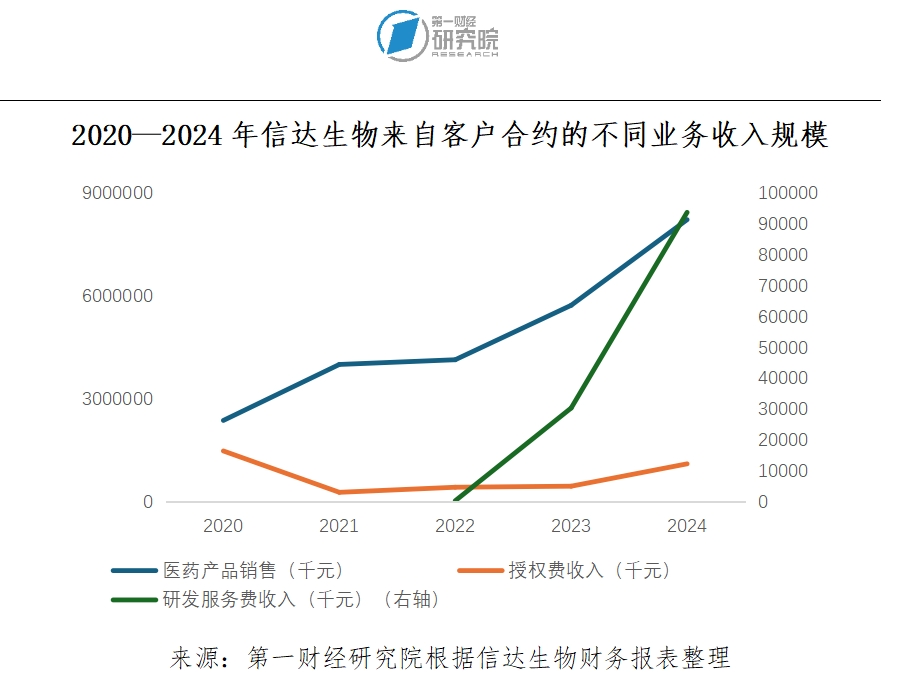
然而,我们在调研中发现,信达生物其实早就已经走向海外。信达生物将企业的成长划分为三个阶段:最基础的是“in China, for China”(中国研发,在中国市场提供产品);其次是“in China, for Global”(中国研发为主,在全球市场提供产品),目前信达基本处于这一阶段;最后的一个阶段则是“in Global, for Global”(全球研发,在全球市场提供产品),这也是信达生物发展的终极目标。锚定终极目标,实际上“全球化”早已渗透到这家公司的战略布局、研发合作、人力资源规划等方方面面。
早年,信达生物就通过与美国药物巨头礼来的合作,融入全球市场,提升自己的全球竞争力。近年,信达生物在印度尼西亚合作伙伴抛出橄榄枝后,产品顺势进入当地市场。这家带着全球化理念的药企在走向全球过程中的体会和经验值得我们去了解。
一、以创新和高品质推动业务出海
对中国生物医药企业而言,目前常见的国际合作模式有三种,分别是license-out(对外授权)、license-in(授权引进)以及合作研发开发等。合作研发开发较容易理解,另外两种模式简单来说,license-out指的是企业将自己的知识产权授权给海外企业,license-in则是反过来将海外知识产权引入国内。
通常而言,中国创新药企业出海会通过license-out或合作研发开发这两类方式进行。而在信达生物成立至今的近15年中,企业在这两种出海模式下均有自己的实践。
1.以高质量产品推动研发合作
信达生物出海是从和外企合作开始的,正是信达生物对创新的坚持促成了与国际机构的合作。大型的国际合作对国内药企而言,意味着在全球范围内的行业知名度提升,也带来了资金上的支撑。
自成立以来,信达生物已经与国际机构达成30多项战略合作,合作对象包括美国礼来、罗氏制药、武田制药以及赛诺菲等国际知名企业。其中,信达生物与全球500强企业美国礼来达成的多次全面合作,总金额超过了25亿美元,对于中国生物制药行业而言,这样的合作规模是巨大的。
礼来是信达生物最重要的海外合作伙伴之一。这样的国际合作关系最早可追溯到2015年,双方达成了战略联盟,计划在未来十年中合作推出至少三种潜在肿瘤治疗药物。具体来看,合作涉及药物的开发、生产以及商业化等环节。信达生物将这次合作视作“发展的里程碑”。回到2015年,彼时信达生物成立还未满五年,这家“新”企业究竟是如何促成高质量的海外合作的?
第一个关键因素是企业的创新能力。俞德超博士对此次合作的原因进行了分析,认为“创新是我们抓住此次合作机会的关键所在。”信达生物自创立以来就强调创新。当时的信达生物就拥有全球自主知识产权的创新新药品种、国际化的研发团队以及先进的技术水平,得到了美国礼来的关注。
其次,信达生物告诉我们,产品质量同样重要,产品一定要经得起海外企业的验证。当产品质量足够好,自然而然地就能够最终达成合作。
然而,高质量说起来容易,做到却有不小的难度。事实上,信达生物为了达成与礼来的合作也做了一定的取舍。信达生物在生产、研发、临床等环节都是依据国际标准设计、建造和运行的。然而,作为世界知名药企,美国礼来遵循的标准甚至高于美国食品药品监督管理局的标准。要促成合作,经得起礼来的审计,信达生物当时收到的是一份300多页的整改清单。完成这样的整改需要大量时间和资金投入,在人力有限的情况下,信达生物毅然决然将当时企业研发进展最快的利妥昔单抗生物类似药IBI301项目暂停,专门对厂房进行升级改造。
信达生物通过这样的做法,进一步提升了产品的质量,开启了与礼来的长期合作。其实,“高质量”三个字也写在企业的使命和目标中,是企业经营的理念。正是由于这个原因,信达生物愿意作出牺牲,最终成功与礼来建立起战略合作关系。目前,信达生物所有的产线都同时符合中国国家药品监督管理局(NMPA)、美国食品药品监督管理局(FDA)以及欧洲药品管理局(EMA)的药品生产质量管理规范要求,为企业与海外药企合作提供了重要基础。
2.License-out试水新兴市场
2022年,信达生物的产品——达攸同®(贝伐珠单抗注射液,印尼商标: Bevagen®)得到了印度尼西亚食品药品监督管理局(BPOM)的批准。由此,信达生物实现了首次license-out模式下的出海,拥有了第一件在海外上市销售的产品。
为什么是印度尼西亚?信达生物认为这可能并不完全是一个精心选择后的结果。
从外部环境来看,印度尼西亚的生物医药行业相对落后,不论是创新药还是生物类似药对当地来说都是很新的概念。以针对PD-1靶点的药物产品为例,中国本土市场竞争激烈,而印尼没有本土产品,只能依赖价格昂贵的进口产品。因此,当地市场本身对信达生物高性价比的生物药产品有着较强的需求。
然而,对于药企而言,有需求并不代表着能够轻易地进入海外市场。在调研中,企业告诉我们,印度尼西亚对本地生产商有保护措施,信达生物的产品能够进入印尼市场与引入当地的合作伙伴有一定关系,这家合作企业恰好拥有一定的生物药生产能力。与此同时,这款生物类似药产品在印尼的审批过程也比较顺利。在多重因素的共同作用下,信达生物的产品顺利出海。这项交易本质是license-out,但产品生产过程由当地合作伙伴一起参与,信达生物也为药品的生产提供了一些技术支持。对信达生物而言,这种产品出海模式能够为企业获得一笔可观的授权费用以及原材料贸易收入。
二、出海进行时——风浪也是常有的
1.产品竞争力并不是出海的全部
有竞争力的产品是进入海外市场的必要条件,但是药物产品是否能成功走向海外市场还受到多方面因素影响。2022年信达生物通过license-out模式欲将针对PD-1靶点的信迪利单抗在美国上市却被美国监管机构拒绝的经历对中国药企出海也有一定的借鉴意义。
信达生物的信迪力单抗未获得FDA(即美国食品药品监督管理局)批准的一个重要理由是因为该产品只在中国进行了临床试验,但美国FDA认为还需要美国的临床实验数据。在调研中,信达生物告诉我们,实际上企业在申报FDA上市前,FDA相关负责人曾两次来到信达生物进行实地调研,当时给出的建议是使用中国的数据去美国上市产品。然而,伴随两国相关政策的变化,信达生物的信迪利单抗在这次申请后并没有成功获得上市批准。
对比信达生物“成功”与“失败”的license-out经历,可以看到宏观环境的变化给企业发展带来变数,这背后反应出中国药企出海时普遍会遇到的一个问题——临床试验数据如何得到海外的认可?目前,国内施行的是《药品生产质量管理规范(2010年修订)》。伴随国内创新药企快速发展,近五年中临床试验相关的标准也得到了不断优化。比如,2020年,由国家药品监督管理局会同国家卫生健康委员会组织修订的《药物临床试验质量管理规范》发布并施行;2024年,又施行了《药物临床试验机构监督检查办法(试行)》等。然而,当前中国的相关标准仍未获得国际普遍认可,药企出海的难度也因此增加。
解决这个问题或许需要药企与政府相关机构的共同努力。一方面,对药企自身而言,信达生物的经历告诉我们,药企在推动产品出海的过程中需要进一步完善临床试验的布局。而另一方面,政府相关机构需持续优化药品生产质量管理规范。2023年,国家药品监督管理局成为国际药品检查合作计划(即PIC/S,全称为Pharmaceutical Inspection Co-operation Scheme)的正式申请者。通过加入国际药品检查领域的权威机构,中国的标准或能够得到更多国家的直接认可。
2.企业出海更加重视供应链风险
创新药领域广为流传着一个说法——新药研发需要耗时10年,耗费10亿美元,最终研发成功率却不足10%。对创新药企而言,企业的研发本身就面临着较高的风险。然而,随着国际地缘格局的变化,对中国创新药企业来说,供应链风险日益突出。国内生物医药企业在药品研发中的耗材、生产过程中的原材料以及仪器设备等,许多都来自海外。企业也越来越重视上游原材料、仪器设备供应的稳定性、时效性、成本等问题。
一方面,对开发新药的企业来说,需要与其他同类型企业“抢时间”来推动产品上市,速度就是竞争力。同时,生物制药的原料往往也有温度控制要求。因此,原料的供应时效对信达生物而言至关重要。然而,原料从海外进口意味着运输距离长,如果海关对通关申报产生异议,导致货物在海关滞留时间延长,会成为企业潜在的供应链风险。
另一方面,地缘政治等因素对供应链稳定性的影响越来越大。关税变化可能会影响企业的成本。在极端情景下,如果供应商直接断供,甚至会直接影响到企业的生产经营活动。
无论是物流因素还是地缘政治因素都是不可控的。伴随国内企业竞争力增强,国产替代甚至不仅起到了“替代”的效果,还降低了企业的供应链风险。对药企而言,并不是所有上游产品都能够简单地替换,有些物料的替换需要企业重新做实验,部分甚至需要通过国家药监局的审批,而审批周期又很长。目前,布局海外供应链基地正成为国内医药企业进一步提升供应链安全性的重要探索方向。
三、志在全球的谋划布局
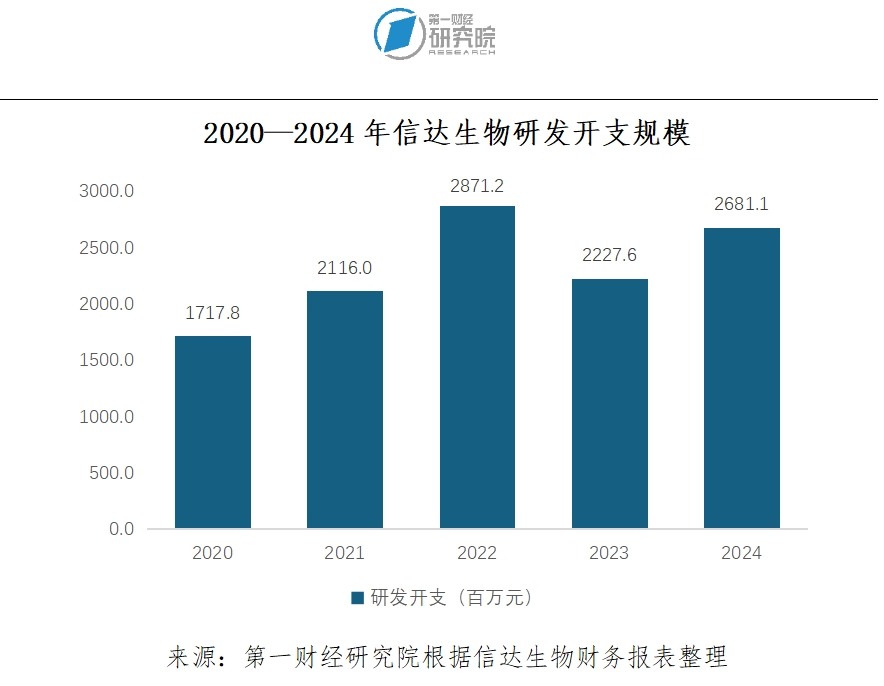
目前信达生物对未来全球化发展的布局已经在紧锣密鼓地推进。研发作为创新药企业竞争力的重要来源,一直是信达生物最重视的环节。2020-2024年,信达每年的研发开支均超过了15亿元,但具有国际雄心的信达生物对这一点却看得很清楚,一位业务负责人表示,目前企业的研发只能说是“国内领先,但还不敢说国际领先”。
然而,正如前文所述,对信达生物而言,他们的志向一直在全球市场,“以创新为基石,走全球化道路”也正是信达生物的发展战略,企业有着明确的三个阶段的规划。信达生物还定下了到2030年两款first-in-class(首创新药)产品在全球获批的明确目标。根据FDA的定义,first-in-class指的是使用全新的、独特的作用机制来治疗某种疾病的药物,也就是我们通常说的首创药。
信达生物下一阶段产品组合的规划中包括了两类产品:一类是全球竞争力有限,只在中国商业化的产品,即是“in China,for China”;而另一类则是有潜在全球竞争力的、first-in-class的产品。对于后者,信达生物除了在国内进行临床试验,也会推动国际多中心协同开发;同时,会尝试通过自身力量将产品在全球商业化。信达生物认为,目前license-out模式下,中国企业的产品在海外市场的开发、商业化以及销售过程中基本没有参与,从某种意义上来说这并不算真正的企业全球化。信达生物需要在这一阶段中培养自身将产品推向全球市场服务患者的能力。
信达生物的全球化志向显而易见,而企业的研发布局也一直是基于这个目标来设置的。
从投资方面来看,目前,信达在杭州和苏州拥有生产基地,在上海则拥有全球研发中心。在海外方面,信达生物在美国加州也建立了研发中心,主要是看重当地的生物医药相关人才资源。从布局来看,加州研发中心的发展方向更偏重疾病问题。同时,由于更贴近全球市场,加州研发中心也会涉及临床研究,助力信达生物的产品完成全球化开发,从而使产品面向全球市场。
致力于全球市场的信达生物也非常重视专利布局。创新药企业往往研发投入巨大,国际药企为了确保技术的经济利益,往往会对新技术进行广泛的专利布局,以确保产品不被仿制,从而获得足够的回报。对于后来者信达生物而言,打开国际市场需要谨慎面对专利问题。为了避免进入国际市场时遇到专利侵权等问题,信达生物在研发的早期就会与海外团队合作,检查并分析这些国家的专利,进行风险排查,为企业后续的全球化发展提供支撑。
四、总结
1.创新为基础,以国际高标准要求自身,提升出海竞争力。创新能力以及产品质量是企业走全球化道路的基石。对生物药出海而言,信达生物的经验告诉我们,企业应更多关注并满足海外市场对药物临床试验的要求,对有着较强创新性的新药可以采取国际多中心临床试验的方式。
2.降低对海外上游材料的依赖性,提升供应链韧性。信达生物许多上游产品均是来自海外,海关流程、地缘政治等因素对原材料供应的时效性、稳定性、库存成本等方面有着较大影响。在这样的背景下,信达生物通过部分国产替代的方式降低海外不确定因素带来的影响,同时也在一定程度上降低了采购成本。
3.提前排查专利,规避侵权风险。目前,欧美等地的生物医药研发依然处在较高水平,同时当地的企业拥有较为完备的专利布局。中国创新药企可以在产品研发的早期加强对海外专利的检查和研究,尽量避免因专利侵权影响企业出海的情况。
(本文题图来源:第一财经)
——
文 | 李嘉怡 第一财经研究院研究员
联系我们 | yicairi@yicai.com

如需获得授权请联系第一财经版权部:banquan@yicai.com
文章作者

德勤中国携手第一财经研究院:从三年前引领为始,建中企出海全链路服务体系
此次签约标志着财经媒体智库与专业服务机构的跨界联动进入新阶段,未来双方将开展深度合作。
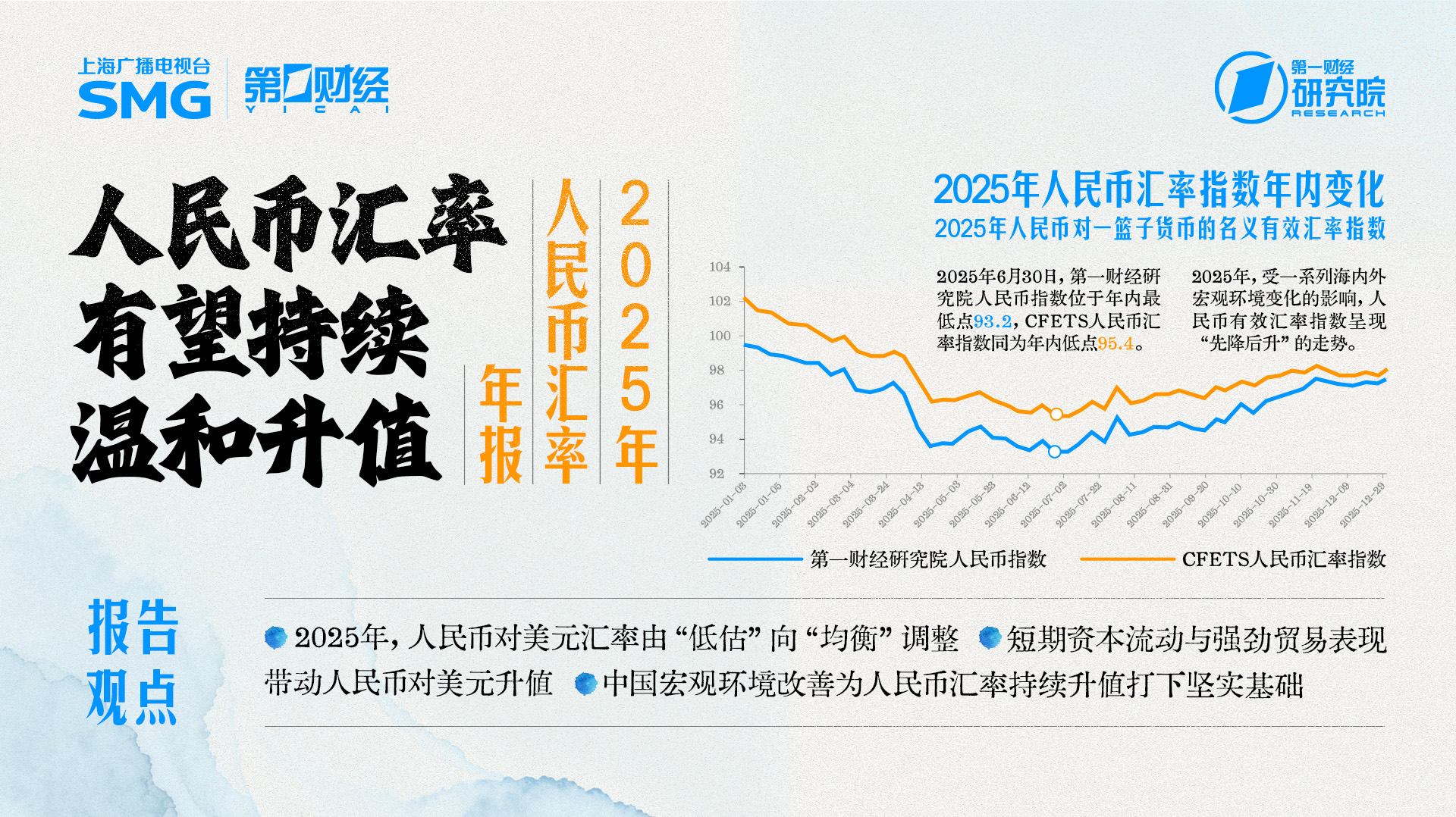
第一财经研究院《2025年人民币汇率年报》发布!
2025年人民币表现出较强的韧性,呈现出“先降后升”的走势,对美元出现明显的“补涨”行情。

出海新变量|从产品授权到平台合作,创新药出海迈入新阶段
信达与礼来敲下超88亿美元的重磅交易。

中国对英投资的“绿色新现实”:在气候与金融的双轨驱动下寻求合作确定性 | 跨越山海-国别观察
中英经贸关系将走出单纯的资本博弈,在“新现实”中真正实现韧性增长、绿色协同与互信重建。

2025年工业企业盈利情况有所改善 | 高频看宏观
2026年1月27日第一财经研究院中国高频经济活动指数(YHEI)为1.15,较1月20日上升0.10。
